PCR 반응 중에는 종종 몇 가지 방해 요소가 발생합니다.
PCR의 민감도가 매우 높기 때문에 오염은 PCR 결과에 영향을 미치는 가장 중요한 요소 중 하나로 간주되며 거짓 양성 결과를 초래할 수 있습니다.
위음성 결과를 초래하는 다양한 요인 또한 매우 중요합니다. PCR 혼합물의 필수 성분 중 하나 이상이나 증폭 반응 자체가 저해되거나 간섭을 받으면 진단 검사가 제대로 수행되지 않을 수 있습니다. 이는 검사 효율 저하 및 위음성 결과로 이어질 수 있습니다.
저해 외에도, 샘플 준비 전 운송 및/또는 보관 조건으로 인해 표적 핵산의 무결성이 손상될 수 있습니다. 특히, 고온이나 부적절한 보관은 세포와 핵산의 손상을 초래할 수 있습니다. 세포 및 조직 고정과 파라핀 포매는 DNA 단편화의 잘 알려진 원인이며 지속적인 문제입니다(그림 1 및 2 참조). 이러한 경우에는 최적의 분리 및 정제조차도 도움이 되지 않습니다.
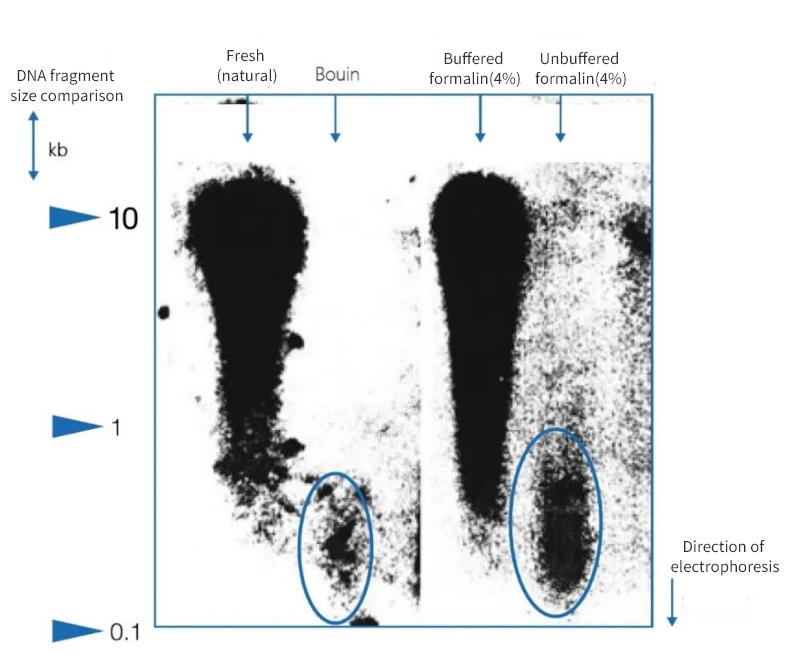
그림 1 | 고정화가 DNA 무결성에 미치는 영향
아가로스 겔 전기영동 결과, 부검 파라핀 절편에서 분리된 DNA의 품질은 상당히 달랐습니다. 고정 방법에 따라 추출물에는 평균 단편 길이가 다른 DNA가 존재했습니다. DNA는 동결된 시료와 완충된 중성 포르말린에 고정했을 때만 보존되었습니다. 강산성 부앵 고정액이나 완충되지 않은 포름산 함유 포르말린을 사용했을 때 DNA가 상당히 손실되었습니다. 남은 부분은 고도로 단편화되어 있습니다.
왼쪽에서는 조각의 길이가 킬로베이스 쌍(kbp)으로 표현됩니다.
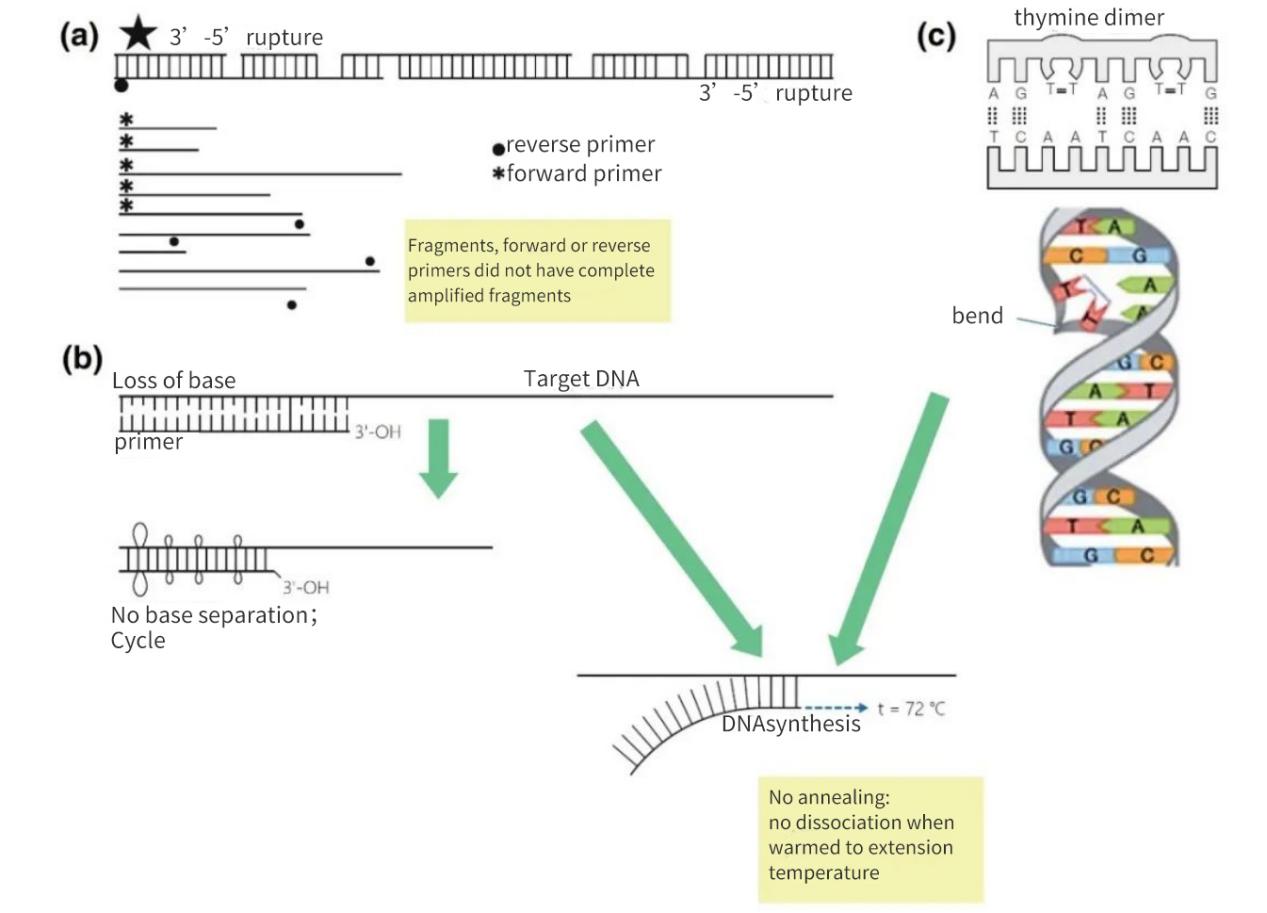
그림 2 | 핵산 표적의 무결성 손실
(a) 두 가닥 모두 3'-5' 간격이 있으면 표적 DNA가 끊어집니다. 작은 단편에서는 DNA 합성이 여전히 일어납니다. 그러나 DNA 단편에 프라이머 어닐링 부위가 없는 경우 선형 증폭만 발생합니다. 가장 유리한 경우, 단편들이 서로 재포화될 수 있지만, 수율은 낮고 검출 수준 이하일 것입니다.
(b) 주로 탈퓨린화 및 티미딘 이합체 형성으로 인한 염기 손실은 수소 결합 수의 감소와 Tm의 감소로 이어진다. 연장된 가열 단계 동안 프라이머는 기질 DNA에서 녹아 떨어져 나가며, 덜 엄격한 조건에서도 어닐링되지 않는다.
(c) 인접한 티민 염기는 TT 이합체를 형성합니다.
분자 진단에서 흔히 발생하는 또 다른 흔한 문제는 페놀-클로로포름 추출법에 비해 표적 핵산의 방출이 최적화되지 않는다는 것입니다. 극단적인 경우, 이는 위음성으로 이어질 수 있습니다. 끓는 물에 용해시키거나 세포 파편을 효소적으로 분해하면 시간을 크게 절약할 수 있지만, 이 방법은 핵산 방출이 충분하지 않아 PCR 민감도가 낮은 경우가 많습니다.
증폭 중 중합효소 활성 억제
일반적으로 저해는 최적이 아닌 PCR 결과를 초래하는 모든 요인을 설명하는 개념으로 사용됩니다. 엄격히 생화학적 관점에서 저해는 효소의 활성에 국한됩니다. 즉, DNA 중합효소의 활성 부위 또는 보조 인자(예: Taq DNA 중합효소의 경우 Mg₂+)와의 상호작용을 통해 기질-산물 전환을 감소시키거나 방지합니다.
샘플이나 다양한 완충액 및 시약을 함유한 추출물의 성분은 효소를 직접 억제하거나 보조 인자(예: EDTA)를 가두어 중합효소를 불활성화하고 결과적으로 PCR 결과가 감소하거나 거짓 음성이 될 수 있습니다.
그러나 반응 성분과 표적을 포함하는 핵산 사이의 많은 상호작용은 'PCR 억제제'로도 불립니다. 분리로 인해 세포의 온전성이 손상되고 핵산이 방출되면, 샘플과 주변 용액 및 고체상 사이에 상호작용이 발생할 수 있습니다. 예를 들어, '스캐빈저'는 비공유 결합을 통해 단일 가닥 또는 이중 가닥 DNA에 결합하고, PCR 반응 용기에 도달하는 표적의 수를 감소시켜 분리 및 정제를 방해할 수 있습니다.
일반적으로 PCR 억제제는 대부분의 체액과 임상 진단 검사에 사용되는 시약(소변의 요소, 혈액의 헤모글로빈 및 헤파린), 식이 보충제(유기 성분, 글리코겐, 지방, Ca2+ 이온) 및 환경 성분(페놀, 중금속)에 존재합니다.
| 억제제 | 원천 |
| 칼슘 이온 | 우유, 뼈 조직 |
| 콜라겐 | 조직 |
| 담즙산 | 대변 |
| 헤모글로빈 | 혈액 속에서 |
| 헤모글로빈 | 혈액 샘플 |
| 부식산 | 토양, 식물 |
| 피 | 피 |
| 락토페린 | 피 |
| (유럽) 멜라닌 | 피부, 머리카락 |
| 미오글로빈 | 근육 조직 |
| 다당류 | 식물, 배설물 |
| 프로테아제 | 우유 |
| 요소 | 오줌 |
| 점액다당류 | 연골, 점막 |
| 리그닌, 셀룰로스 | 식물 |
더 흔한 PCR 저해제는 박테리아와 진핵 세포, 비표적 DNA, 조직 기질의 DNA 결합 거대분자, 그리고 장갑이나 플라스틱과 같은 실험실 장비에서 발견될 수 있습니다. PCR 저해제를 제거하는 가장 좋은 방법은 추출 중 또는 추출 후 핵산을 정제하는 것입니다.
오늘날 다양한 자동 추출 장비가 많은 수동 프로토콜을 대체할 수 있지만, 표적의 100% 회수 및/또는 정제는 달성된 적이 없습니다. 정제된 핵산에 잠재적인 저해제가 여전히 존재하거나 이미 작용했을 수 있습니다. 저해제의 영향을 줄이기 위한 다양한 전략이 존재합니다. 적절한 중합효소의 선택은 저해제 활성에 상당한 영향을 미칠 수 있습니다. PCR 저해를 줄이는 다른 입증된 방법으로는 중합효소 농도를 증가시키거나 BSA와 같은 첨가제를 적용하는 것이 있습니다.
PCR 반응 억제는 내부 공정 품질 관리(IPC)를 사용하여 입증할 수 있습니다.
에탄올, EDTA, CETAB, LiCl, GuSCN, SDS, 이소프로판올, 페놀 등 추출 키트에 포함된 모든 시약 및 기타 용액은 철저한 세척 과정을 통해 핵산 분리물에서 제거해야 합니다. 이러한 용액은 농도에 따라 PCR을 활성화하거나 억제할 수 있습니다.
게시일: 2023년 5월 19일
 중국어 网站
중국어 网站